当记忆被悄悄 “偷走”,我该如何“守护你”
阿尔茨海默病最早在1906年由德国医生Alois Alzheimer博士发现。他描述了一位记忆力减退、精神错乱的欧洲老年女性病人的大脑变化,报道其脑内“淀粉样斑块”和“神经纤维缠结”的主要特点[1]。为了纪念Alzheimer博士对该疾病的贡献,将其命名为Alzheimer。一个多世纪后,全球患者已超 5500 万,而中国就有大约1000多万患者。
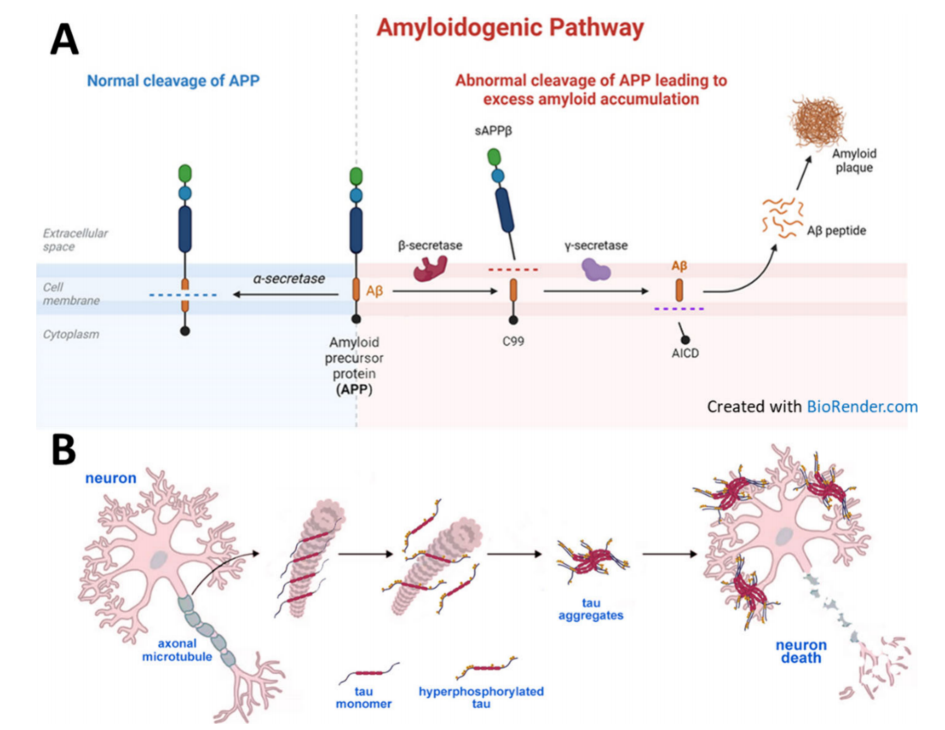
A.淀粉样前体蛋白(APP)的正常与异常裂解;B.. tau蛋白形成神经原纤维缠结,进而导致神经元死亡[2].
一、不仅仅是遗忘——记忆滑坡三部曲
阿尔茨海默病的发展像一条缓慢下坡的滑道,常被划为三个阶段:临床前期——轻度认知障碍(MCI)——痴呆[1]。临床前期患者无任何症状,但脑脊液可检查到:Aβ42下降、总tau和p-tau181升高,或淀粉样蛋白PET显像呈阳性,这些变化可早于临床诊断10-20年[3]。进入MCI阶段,患者最明显的表现是:近期记忆滑坡——刚吃过饭却问“午饭吃什么”;执行复杂任务(如理财)速度和准确性下降,但日常生活尚能自理[1,3]。发展为痴呆后,语言、执行、行动全面衰退。出现命名性失语,空间感知变差,人格和情绪也发生改变,抑郁、焦虑,部分患者出现妄想或幻视[1]。中度阶段,经常重复提问,需要协助穿衣、洗澡;到了重度,走路不稳、吞咽困难、大小便失禁,最终因感染、全身器官衰竭而离开[1]。整个病程大脑影像也同步萎缩:MRI显示海马体积每年缩小5%以上,PET-CT可见淀粉样斑块呈“天女散花”样分布,tau缠结像“火焰”从内侧颞叶向顶枕区蔓延[3,4]。

二、治疗——从“对症”到“对因”的三级跳
临床上使用的第一批药物——胆碱酯酶抑制剂(多奈哌齐、卡巴拉汀、加兰他敏)和NMDA受体拮抗剂(美金刚),通过暂时提升脑内乙酰胆碱浓度或调节谷氨酸能传递,在6-12个月内轻度改善认知评分,但无法阻断潜在病理进程[4]。随着“淀粉样级联假说”获临床验证,2021-2025年相继上市三款抗Aβ单抗药物,Aducanumab可清除斑块,但疗效争议使临床应用受限;Lecanemab在试验中将18个月CDR-SB评分下降速度减缓27%,且脑内淀粉样负荷降至阴性阈值以下,却伴随12.6%的脑水肿发生率[4,5];Donanemab主要针对tau轻-中度人群,iADRS评分下降减缓35%,ARIA-E却高达24%[4]。
这些药物的共同机制是:抗体Fc段与脑内小胶质细胞FcγR结合,介导吞噬并清除Aβ斑块,来减轻突触毒性和炎症反应[5,6]。但单靶点策略显然不足,科学家目前正在测试协同方案。
三、挑战与机遇——在“山重水复”中寻找“柳暗花明”
阿尔茨海默病的治疗之路并非坦途,但挑战越严峻,机遇越清晰。
1. 疗效天花板——“多靶点联合”破壁
现有抗Aβ单抗平均只能将认知衰退速度减缓25–30%,剩余70%的下降与tau缠结、脑血管病变、慢性炎症及突触持续丢失有关。破局之策是协同疗法:抗Aβ抗体 + 抗tau寡核苷酸+ NLRP3炎症小体抑制剂 + 改善脑能量代谢的GLP-1受体激动剂, 全球多项II/III期试验已启动[4]。
2. 副作用ARIA——“脑穿梭”降风险
当抗体与血管壁内沉积的Aβ结合后,激活补体与小胶质细胞,引发血管源性水肿或微出血,ARIA-E风险增加3–4倍,临床需多次MRI监测[4,5]。但“脑穿梭”技术把抗体Fc段改造成可结合脑血管内皮转铁蛋白受体,实现主动转运,使脑内药物浓度提升5–8倍,小鼠模型中ARIA样病理下降>70%[6]。
3. 诊断滞后——“血浆早筛”进社区
当出现明显症状时,内侧颞叶神经元已死亡约30%,而确诊金标准——淀粉样蛋白PET或脑脊液检测——价格昂贵或有创[3]。随着高灵敏度分析平台和检测技术的进步,血液标志物的诊断精度和可靠性不断提高。超灵敏单分子阵列与质谱法使血浆p-tau217+Aβ42/40组合提前10–20年“预告”大脑病理,且成本降至100元以内,预计2026年进入医保筛查目录,让“记忆体检”像测血压一样简单[1,3]。
4. 人群差异——“多组学图谱”精准分型
血浆p-tau217、Aβ42/40等切值主要基于欧美白人队列,东亚、非洲裔数据不足[4]。整合GWAS-蛋白质组-代谢组可构建个体化“AD多组学风险评分”,实现“一人一图”精准干预[1]。
5. 生活方式——“每日四件事”降风险
坚持MIND饮食(绿叶菜、坚果、橄榄油、鱼类)、每周150分钟中等强度有氧 + 阻力训练、社交与认知训练,可使APOE ε4携带者的发病风险降低40%[1]。
6. “医保+网络”——打通最后一公里
国家卫健委已将AD早筛纳入“健康中国2030”专项行动;上海、浙江、北京等地试点“记忆门诊-社区-家庭”三级网络,计划2027年覆盖60岁以上人群80%[4]。
结语:
在早筛、脑穿梭、联合治疗、生活方式与政策齐发力下,我们相信:未来,阿尔茨海默病将不再是“漫长的告别”,而是“持续的守护”。
参考文献:
1. Krishnamurthy HK, Jayaraman V, Krishna K, et al. An overview of the genes and biomarkers in Alzheimer's disease. Ageing Res Rev. 2025;104:102599. doi:10.1016/j.arr.2024.102599
2.Tenchov R, Sasso JM, Zhou QA. Alzheimer's Disease: Exploring the Landscape of Cognitive Decline. ACS Chem Neurosci. 2024;15(21):3800-3827. doi:10.1021/acschemneuro.4c00339
3. Humpel C. Identifying and validating biomarkers for Alzheimer's disease. Trends Biotechnol. 2011;29(1):26-32. doi:10.1016/j.tibtech.2010.09.007
4. Hardy J. Alzheimer's Disease: Treatment Challenges for the Future. J Neurochem. 2025;169(8):e70176. doi:10.1111/jnc.70176
5. Söderberg L, et al. Lecanemab, Aducanumab, and Gantenerumab - Binding Profiles to Different Forms of Amyloid-Beta Might Explain Efficacy and Side Effects in Clinical Trials for Alzheimer's Disease. Neurotherapeutics. 2023;20(1):195-206. doi:10.1007/s13311-022-01308-6
6. Xing M, Song W. Improving Alzheimer's disease immunotherapy. Science. 2025;389(6760):571-572. doi:10.1126/science.adz8959
7. Ahmad F, Haque S, Chavda V, Ashraf GM. Recent Advances in Synaptosomal Proteomics in Alzheimer's Disease. Curr Protein Pept Sci. 2021;22(6):479-492. doi:10.2174/1389203722666210618110233
