引言
角膜新生血管(CoNV)是一种高发的眼部疾病,严重威胁视力,目前临床常用抗VEGF药物(如Ranibizumab),但存在眼部滞留时间短、药效持续差、需频繁注射等问题。如何提高抗VEGF药物在眼表的滞留时间,并增强其对VEGF及其受体的双重抑制作用,从而提升对角膜新生血管的治疗效果呢?
01 一句话看懂
山东第一医科大学团队最新发表在《Chemical Engineering Journal》的成果:自组装多肽水凝胶 NQ-Ran 通过“中和VEGF 和阻断VEGFR”,小鼠角膜新生血管7天退缩约70%,药物滞留时间从6h延长到48h!
02 研究亮点
智能载体:NapFF 自组装纳米纤维,包裹 Ranibizumab,结膜下注射即成凝胶“药库”。
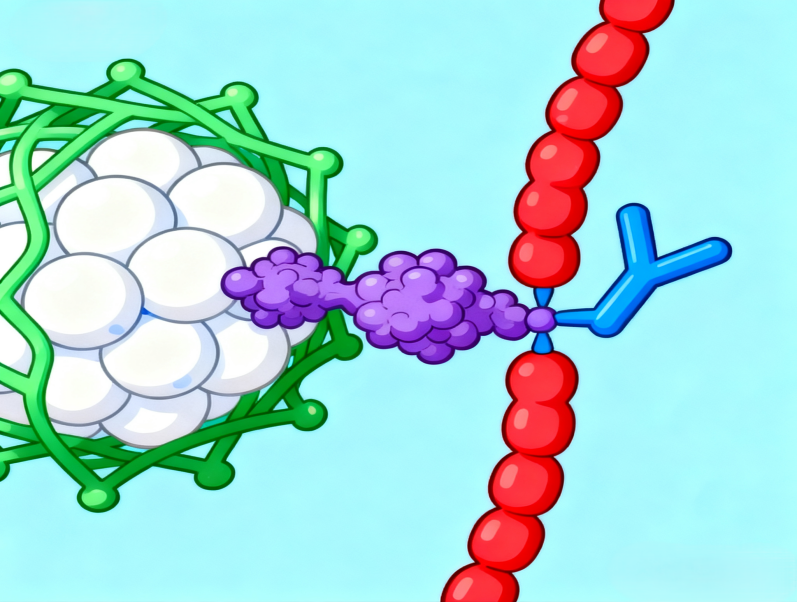
双靶协同:Ran 中和 VEGF,Q 肽抢占 VEGFR,一箭双雕关掉血管信号。
抗炎加码:IL-1β、TNF-α、IL-6 同步下调,血管“火苗”被连根拔起。
安全满分:角膜、视网膜、心肝脾肺肾 H&E 染色无损伤,临床转化可期。
03 技术路线
① 多肽合成
- 固相合成 QKRKRKKSRYKS(Q)与 NapFF-QKRKRKKSRYKS(NQ)
- HPLC 纯度>95%,ESI-MS 确认分子量
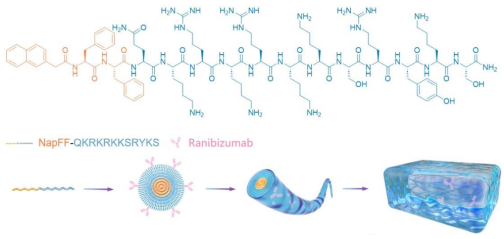
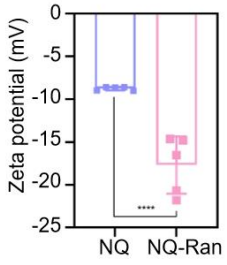
② Ranibizumab 偶联
- EDC/NHS 活化羧基,与NQ的-NH2反应24 h
- BCA 测载药率:84.3% ± 0.8%
③ 自组装成凝胶
- 室温静置 5 min,NQ-Ran 形成 10–15 nm 纳米纤维(TEM)
- 流变仪:G’(储存模量)>G”(损耗模量),证实凝胶态
④ 体内滞留与分布
- DiR 标记,IVIS 实时成像,48 h眼表荧光强度仍为游离 Ran 组的6倍
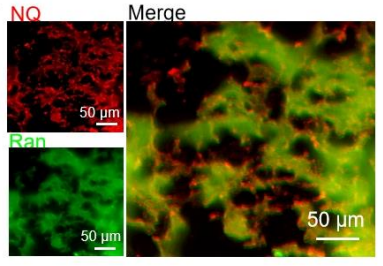
- 角膜 flat-mount:NQ-Ran 与 CD31 共定位,血管靶向性一目了然
⑤ 药效与机制
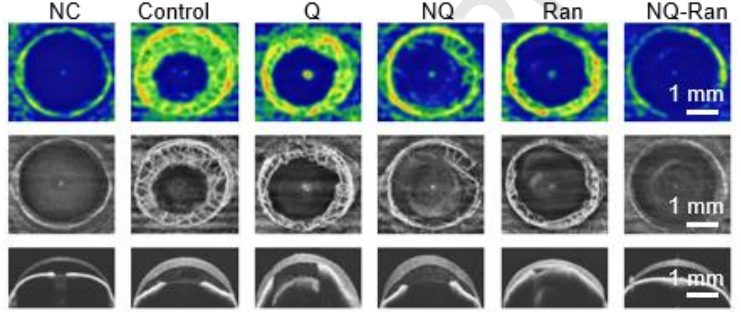
- 碱烧伤 C57BL/6J 模型,D1/D3/D5 结膜下注射 5μL(240μg/mL)
- 7 天后 OCTA 测血管面积,NQ-Ran 组仅 22%(PBS 组 100%)
- RNA-seq:VEGFA、Flt1、Icam1 下调;抗炎基因 Fads2、Diaph3 上调
- 蛋白芯片:TNF-α ↓10 倍,IL-10 ↑3 倍
04 数据说话
新生血管面积↓78%
中央角膜厚度↓42%
药物滞留时间↑8 倍
炎症因子 TNF-α ↓10 倍
05 临床意义
碱烧伤、角膜移植后排斥,最怕的就是“血管乱长”。本研究把临床常用的 Ranibizumab 装进自凝胶“缓释仓库”,一次结膜下注射就能让药物在眼表停留 48 h,并同时阻断 VEGF 及其受体。若后续通过剂量-时效优化实现“一针管一个月”,不仅能降低多次穿刺带来的结膜出血、感染等并发症;而且为角膜移植术前“退血管”和术后“防排斥”提供了一条微创、长效、可规模化的新方案。
06 ReedBiotech生物——为本研究提供硬核数据
本研究中 IL-1β、IL-6、TNF-α 检测结果均使用【ReedBiotech生物】试剂盒完成:
✔高敏型试剂盒,灵敏度可达0.09 pg/mL
✔微量法试剂盒,上样仅需25 μL
✔一步法试剂盒,完成检测仅需1.5 h
✔批内差<6%,符合 SCI 论文审稿要求
✔覆盖人/小鼠/大鼠等物种,现货当天发

|
名称 |
货号 |
灵敏度 |
检测范围 |
|
MF-小鼠白介素1β(IL-1β)酶联免疫吸附 测定试剂盒 |
RE1074MF |
0.16 pg/mL |
0.78-50 pg/mL |
|
MF-小鼠白介素6(IL-6) 酶联免疫吸附测定试剂盒 |
RE3186MF |
4.69 pg/mL |
7.81-500 pg/mL |
|
MF-小鼠肿瘤坏死因子α(TNF-α)酶联免疫吸附测定试剂盒 |
RE1060MF |
6.56 pg/mL |
10.94-700 pg/mL |
|
小鼠血管内皮细胞生长因子A (VEGF-A) 酶联免疫吸附测定试剂盒 |
RE1061M |
18.75 pg/mL |
31.25-2000 pg/mL |
|
MF-小鼠白介素10(IL-10)酶联免疫吸附测定试剂盒 |
RE3187MF |
1.88 pg/mL |
3.13-200 pg/mL |
|
FS-小鼠γ干扰素诱导单核细胞因子(MIγ/CXCL9)酶联免疫吸附测定试剂盒 |
FS2783M |
1.42 pg/mL |
31.25-2000 pg/mL |
